مجتمع
لوغاريتمات البروتين: الطريق إلى نوبل في الكيمياء
جهود العلماء الحائزين نوبل في الكيمياء لهذا العام، كشفت مدى ضآلتنا، ففي هذا الكون، لا تزال تنبثق عوالم أخرى، لا يقل أبسطها عن الكون تعقيداً.
 حائزو «نوبل» في الكيمياء: ديفيد بيكر، ديمس هاسابيس، وچون چامبر
حائزو «نوبل» في الكيمياء: ديفيد بيكر، ديمس هاسابيس، وچون چامبر
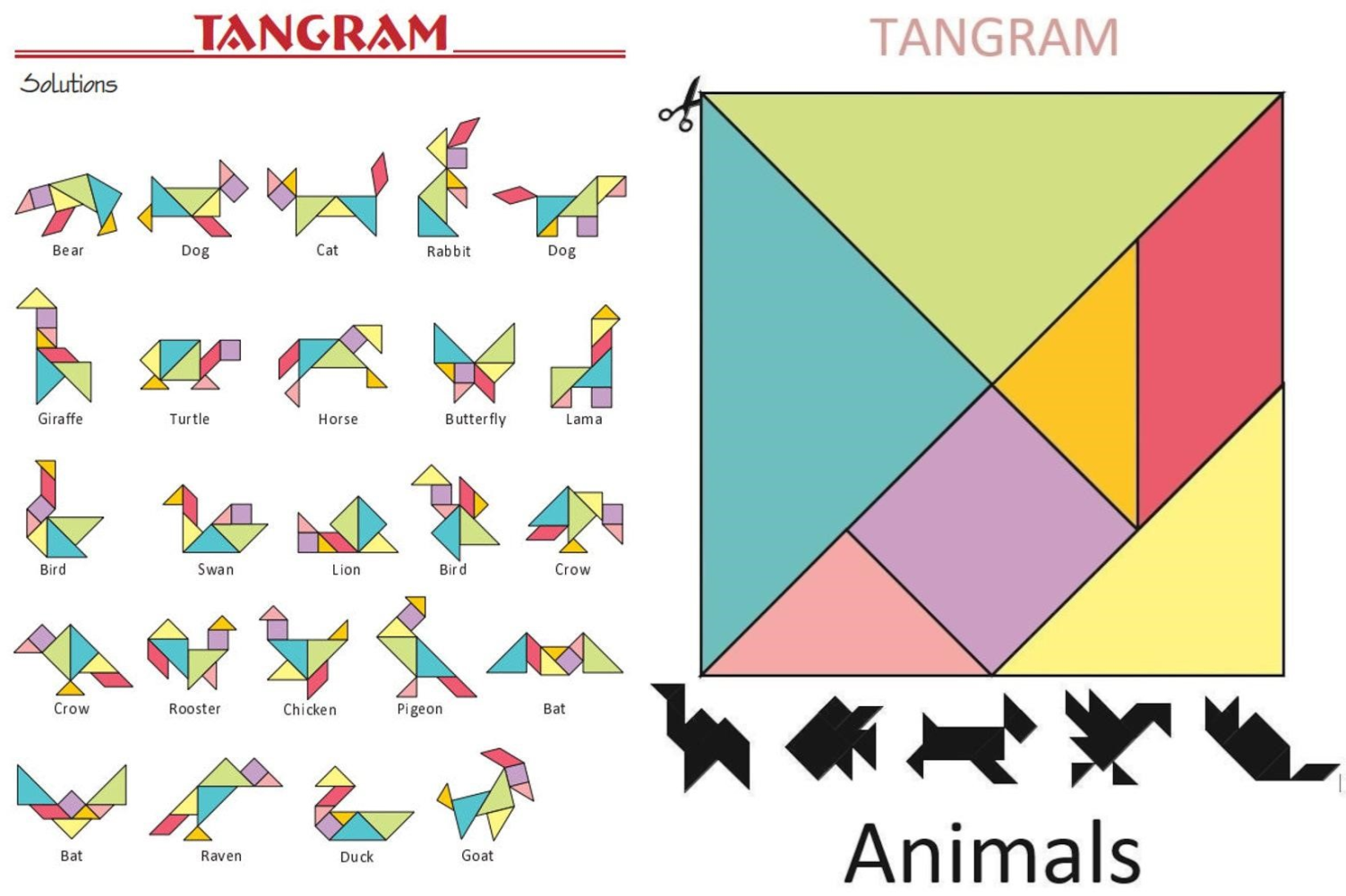
لعبة «Tangram – تانجرام»
مؤكد أنك امتلكت واحدة من ألعاب الألغاز في صغرك، لكن هل سمعت عن لعبة «Tangram – تانجرام»؟ إنها لغز هي الأخرى، غير أنها تمتلك عدداً قليلاً من القطع المعروفة التي يمكن تشكيلها على أكثر من نحو.
يختلف الشكل الناتج باختلاف ترتيب القطع، وطريقة ارتباطها ببعضها البعض. قد يرتب البعض القطع لتنتج أشكال حيوانات، وقد يتمكن آخرون من بناء بيت، أو شجرة أو تكوين أي شكل آخر حتى غير وارد مع ورقة التعليمات. يبدو الأمر مذهلاً، أليس كذلك؟ ماذا لو علمت أن البروتينات المكونة لأجسادنا تفعل الشيء ذاته منذ مليارات السنين؟
البروتينات فعلتها أولاً!
ذهبت نصف جائزة نوبل في الكيمياء لعام 2024 إلى ديفيد بيكر لبناء بروتينات جديدة باستخدام الذكاء الاصطناعي، بينما تشارك في النصف الآخر كل من ديمس هاسابيس وچون چامبر عن جهودهما في التنبؤ ببنية البروتين.
إذا كنت قد قرأت عن جائزة نوبل في الطب فيمكنك تخطي المقدمة، وإذا لم تقرأ فدعني أخبرك باختصار شديد أن أجسادنا المكونة من وحدات بنائية صغيرة تسمى «الخلايا»، تملك داخلها كتيب تعليمات يخبر كل خلية كيف عليها أن تسلك.
هذا الكتيب المتمثل في الجينات يملك لغة خاصة به ينقلها مترجم خاص، هو الحمض الريبوزي الرسول mRNA، الذي يحمل شفرات تلك اللغة إلى الأماكن التي ستجري قراءتها فيها، من ثم تتحول الشفرات إلى أحماض أمينية، في عملية تسمى الترجمة، وترتبط الأحماض الأمينية سوياً مكونة البروتينات.
للبروتينات أهمية عظمى، فإلى جانب أنها تدخل في تكوين جميع خلايا جسم الكائن الحي، من عظام، عضلات، جلد، غضاريف، ريش، قرون، وحوافر، تعد البروتينات عاملاً أساسياً لحدوث التفاعلات الكيميائية على المستوى الخلوي.
تدخل البروتينات في التراكيب المهمة في جسم الكائن الحي، فالأجسام المضادة التي تحارب العدوى في الجسم بروتينات، والإنزيمات اللازمة لحدوث أغلب التفاعلات التي تنظم وظيفة الأنسجة بروتينات هي الأخرى. تعمل بعض البروتينات على نقل المواد وتخزينها داخل الجسم، مثل الفيريتين Ferritin الذي يحمل الحديد، بينما في وقت الحاجة يمكن كسر البروتينات للحصول على الطاقة.
البروتينات، أدوات الحياة الكيميائية، هي المسئول الأول عن التنوع الهائل في الحياة. تتكون البروتينات من وحدات تكوينية تسمى الأحماض الأمينية، ويبلغ عددها 20 حمضاً أمينياً.
تترتب الأحماض الأمينية داخل البروتين الواحد وتكرر ما ينتج عنه عدد هائل من البروتينات، لكن شيئاً إضافياً يزيد من هذا التنوع وهو بناء البروتين، إذ يأخذ هيكل البروتين أشكالاً مختلفة في الفراغ ثلاثي الأبعاد، مما يضفي بعداً جديداً من التنوع. اعتبر سلسلة الأحماض الأمنية مثل بالون طويل، يأتي شخص ما ليثنيه ويخلق منه أشكالاً، هذا هو بالضبط التغير الذي يضفيه تشكل البروتين في ثلاثة أبعاد.
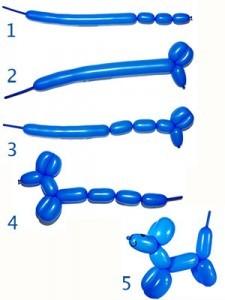
حيوانات البالون
تلتوي سلسلة الأحماض الأمينية وتنثني على بعضها في هيكل ثلاثي الأبعاد. هذا الشكل المميز هو ما يعطي البروتين وظيفته. ولهذا حرص العلماء منذ قديم الأزل على التعرف عليه.
رغم اكتشافها منذ القرن الـ19، احتاج العلماء سنوات من الدراسة الدقيقة استمرت حتى عام 1950 حتى نجح جون كندرو وماكس بيروتس عبر استخدام وسيلة تدعى «التصوير البلوري بالأشعة السينية» لإيجاد أول نموذج ثلاثي الأبعاد للبروتين.
يشمل الأمر تسليط حزمة من الأشعة السينية على البروتين ومراقبة مسار الحزمة حتى النهاية، كما لو كنت تلتقط صورة لشيء ما من جميع الزوايا، ثم تجمع الصور معاً. ولذا استحق العالمان جائزة نوبل في الكيمياء عام 1962.
كيف اكتسبت البروتينات شكلها المميز؟
اعتقد العلماء أن طيات الأحماض الأمينية تشكلت في البروتينات بعشوائية، وأن أي مؤثر من شأنه أن يغير من هذا الشكل، حتى استخدم العالم كريستيان أنفينسن مواد كيميائية تفكك الروابط المكونة لهيكل البروتين ثلاثي الأبعاد، ثم قام بعدئذ بتخفيف المواد المفككة لسحبها بالتدريج.
المفاجأة كانت عودة البروتين إلى الارتباط بنفس الطريقة التي توجد عليها منذ البداية، مما يعني أن لكل بروتين هيكلاً معيناً لا يتغير، وهذا الهيكل يحكم وظيفتها، وقد منح كريستيان أنفينسن جائزة نوبل في الكيمياء عن اكتشافه عام 1972.
تعرض منطق أنفينسن لمعضلة أشار إليها العالم سيراس ليفينثال، إذا كان لدينا بروتين مكون من 100 حمض أميني فقط، وأردنا ترتيب أحماضه الأمينية في الفراغ ثلاثي الأبعاد، مع السماح لها بالطي والانثناء بعشوائية كيفما تشاء، فهناك عدد 1047 من الاحتمالات المختلفة للأشكال التي قد يظهر عليها البروتين.
لفهم ضخامة الرقم فلو سمحنا لسلاسل الأحماض الأمينية بالانثناء بعشوائية، فإنها سوف تستغرق أكثر من عمر الكون للوصول إلى التركيب الصحيح. فكيف إذن يستغرق البروتين بضعة مللي ثانية تترتب فيها الأحماض الأمينية، وترتبط لتخرج بالشكل الصحيح؟!
بربط اكتشافات أنفينسن وليفينثال تبين أن شكل البروتين عملية مقررة من البداية، وأن المعلومات التي تصف كيف تترتب الأحماض الأمينية، وتنثني سلاسلها على بعضها، لا بد وأن تكون محفورة داخل سلاسل الأحماض الأمينية.
هناك قواعد معينة لارتباط الأحماض الأمينية ببعضها البعض. عند وجود مجموعة معينة من الأحماض الأمينية خلف بعضها البعض ستميل إلى الارتباط بطريقة معينة، مما يعني وجود سلسلة بعينها متكررة في البروتينات.
فكر في الأمر على أنه مجموعة من الأطفال، عند التقاء الطفل «أ» و«ب» و«ت»، سيقومون بلعب الغميضة، وقتها ستجدهم داخل دولاب الغرفة، بينما لو التقى الطفل «أ» مع «ب» و«ج» و«ح» سيقومون باللعب في الحديقة، وفي كل لعبة يلعبونها يجلسون بطريقة معينة.
هكذا هي الأحماض الأمينية، عند التقاء -ونعنى بالتقاء إتيان الأحماض خلف بعضها في السلسلة أو بجانب بعضها في هيكل البروتين- مجموعة معينة من الأحماض الأمينية، سترتبط ببعضها بطريقة معينة، مكونة تسلسلاً معيناً، بصرف النظر عن نوع البروتين، فتسلسل الأحماض الثابت يعطي شكلاً معيناً.
لذا يمكننا القول إن كل بروتين مكون من مجموعة من سلاسل الأحماض الأمينية التي ترتبط مع بعضها البعض. تظهر السلاسل أشكالاً معينة لا تتغير أبداً، بينما تتفاعل السلاسل مع بعضها البعض بطريقة مختلفة، فهل يمكن أن نستخدم هذا الشيء الثابت من أجل الكشف عن المتغير؟
يمكننا تشبيه الأمر بلعبة أحجية الـpuzzle لكن هذه المرة لديك الكثير منها، وهناك صور متكررة مشتركة في كل صورة، وعليك حل كل الصور سوياً، الصور هي البروتينات المختلفة، وقطع الـpuzzle المتشابهة المتكررة في الصور هي الأحماض الأمينية. فكيف نجح العلماء في التوصل للأطراف المجهولة في تلك المعادلة؟
المسابقة التي أنقذت العالم
عام 1994، بدأ الباحثون مشروع «CASP» وهي اختصار لجملة التقييم النقدي للتنبؤ ببنية البروتين، الذي سرعان ما تحول لمسابقة. عاماً بعد عام بدأ يتوافد الباحثون من شتى أنحاء الكرة الأرضية للمشاركة فيها. شملت المسابقة بروتينات جرى كشف هيكلها ثلاثي الأبعاد للتو، لكن أحداً من المشاركين لم يطلع عليه، أعطي الباحثون تسلسل الأحماض الأمينية الخاص بالبروتين فقط، وكانت مهمتهم هي التنبؤ بالهيكل ثلاثي الأبعاد الخاص بالبروتين اعتماداً على هذا التسلسل، باختصار شديد لقد أعطوا قطع الصورة الصغيرة وأفضي إليهم حل إحدى صور الـPuzzle.
مضى أكثر من 20 عاماً لم تزد نسبة الدقة التي توصل إليها الباحثون في المسابقة على 40%، حتى جاء عام 2018 حين شارك ديمس هاسابيس وفريقه في المسابقة. ديمس هاسابيس خبير الشطرنج ومبرمج الألعاب ورائد علم الأعصاب، الذي بدأ في استكشاف الذكاء الاصطناعي كذلك.
أسس هاسابيس في عام 2010 شركة «DeepMind» إذ استخدم ما يعرفه عن الشبكات العصبية في المخ، ليطور شبكات عصبية أفضل للذكاء الاصطناعي، لتنشئ شركته نماذج ذكاء اصطناعي خاصة بالألعاب اللوحية، وكانت الطفرة حين هزمت أحد نماذج الذكاء الاصطناعي التي طورها هاسابيس بطل العالم في إحدى تلك الألعاب، لعبة Go.

لعبة Go الشهيرة
لم يكن هم هاسابيس مجرد هزيمة لعبة، لقد ذهب طموحه أبعد بكثير، لذا وبعد عامين من تحقيق هذا الانتصار، أراد هاسابيس شيئاً أنفع للبشرية، فسجل في مسابقة «CASP»، ثم طور وفريقه نموذج AlphaFold الذي أبهر العالم في وقت قياسي إذ سرعان ما وصلت دقة التنبؤات التي حققها إلى 60% لكن هذا لم يكن يكفي أيضاً للفوز بالمسابقة. وهنا جاء دور چون چامبر.
كان چون چامبر مولعاً بالكون، الأمر الذي دفعه لدراسة الفيزياء والفلك، وبحلول عام 2008 عمل في شركة تستخدم كمبيوترات فائقة من أجل محاكاة تراكيب، وحركة البروتين، وقتها أيقن أن معرفته بالفيزياء بشكل ما قد تحل المشاكل الطبية.
في 2011 بدأ چامبر في تحضير الدكتوراه في الفيزياء النظرية في جامعة افتقرت سعة كمبيوتراتها التخزينية، ولأن الحاجة أم الاختراع استخدم چامبر خبراته في تطوير وسائل أسهل لمحاكاة ديناميكيات البروتين. عام 2017 أنهى چامبر الدكتوراه حين سمع بتفوق فريق هاسابيس على بطل لعبة «Go».
فوراً قدم سيرته الذاتية، بعد تداول أخبار سرية عن مشاركة «DeepMind» في مسابقة «CASP»، سرعان ما انضم چامبر إلى الفريق، وساعدته خبرته السابقة في مجال البروتينات على امتلاك أفكار إبداعية، ساعدت في تحسين AlphaFold، وبمجرد أن بدأت المسيرة، حصل چامبر على الترقية، وقاد العمل جنباً إلى جنب مع هاسانيس ليعيدا تشكيل نموذج الذكاء الاصطناعي.
من هنا تطور AlphaFold2 الذي اعتمد على معرفة چامبر بالبروتينات، وعلى الشبكات العصبية المسماة المحولات Transformers. يمكن للنموذج الجديد AlphaFold2 اكتشاف الأنماط في كميات ضخمة من البيانات بطريقة مرنة للغاية، لذا وبعد تزويد النموذج بقاعدة بيانات ضخمة لكل تراكيب البروتينات المكتشفة، وكل سلاسل تتابعات الأحماض الأمينية.
بدأ النموذج يزود النتائج بدقة تعدت الـ90%، مما اضطر منظمي «CASP» إلى إغلاق المسابقة، لقد زود AlphaDFolds تراكيب للبروتينات بنفس الدقة التي فعلتها أشعة إكس غير أن الأخيرة لم تتمكن من العمل على كثير من البروتينات. وقتها وقف أحد مؤسسي CASP متسائلاً، «الآن ماذا؟»
قبل أن تفكر في الطيران، تعلم المشي بطريقة صحيحة
لديفيد بيكر الحائز على نصف جائزة نوبل في الكيمياء العام مقولة مهمة: إذا أردت بناء طائر، فلا ينبغي عليك البدء بتعديل طائر، بل عليك أن تفهم المبادئ الديناميكية الأولية للهواء، والبدء من هناك.
لقد قامت مسابقة «CASP» على مبدأ تنبؤ الهيكل ثلاثي الأبعاد للبروتين في الفراغ، لكن بيكر راح يفكر أبعد من ذلك. لأننا نعلم أن هيكل البروتين يتحكم في شكله، قام ديفيد بيكر بابتكار هياكل بروتينات لا وجود لها في الطبيعية، وإنما يمكن أن تخدم وظائف معينة، واستخدم نماذج حاسوبية معاكسة لنموذج AlphaDFold، إنك لن تحصل على هيكل البروتين من ترتيب سلاسل أحماضه الأمينية، بل العكس.
يضع بيكر هيكل البروتين المنشود، في نموذج حاسوبي يدعو «روزيتا- Rosetta» يملك نفس قاعدة البيانات الضخمة التي عرفناها، ويخبرنا النموذج عن ترتيب، وارتباط تتابعات الأحماض الأمينية في هذا البروتين.
جرب بيكر الأمر مع فريقه على بروتين Top7 المكون من 93 حمضاً أمينياً، لا وجود له في الطبيعة، ولدى حصولهم على تتابع الأحماض الأمينية الخاصة بالبروتين من نموذج روزيتا، وضعوا الچين الخاص بالتتابع الناتج داخل بكتيريا مخصصة، تنتج البروتين المرغوب، ومن ثم استخدموا أشعة إكس لتصوير هيكل البروتين، ليتضح أنه هيكل البروتين الذي أرادوه من البداية، وأن روزيتا فعلاً تبني البروتينات.
بعد جهود هاسابيس، وچامبر، تمكن العلماء من اكتشاف تركيب أكثر من 200 مليون بروتين، وهي البروتينات المكتشفة حتى الآن في الطبيعة، بينما جاء ديفيد بيكر بنموذجه روزيتا، ليبني آلاف البروتينات الأخرى من العدم.
إن كل جهود هؤلاء العلماء تكشف عن مدى تنوع الحياة، سيمكننا تجلي أسرار البروتينات في فهم دقيق لتطور الأمراض، كيف تحدث المناعة تجاه المضادات الحيوية، وكيف يمكن لبعض الميكروبات تحليل البلاستيك؟
أما خلق بروتينات جديدة فقد يطور من لقاحاتنا أو يساعد في تصنيع أدوية مستهدفة. إن جهود العلماء الحائزين نوبل في الكيمياء لهذا العام، كشفت مدى ضآلتنا، ففي هذا الكون، لا تزال تنبثق عوالم أخرى، عوالم لا يقل أبسطها عن الكون تعقيداً، فمتى نكف عن انشغالنا بحدود دورنا في هذا؟